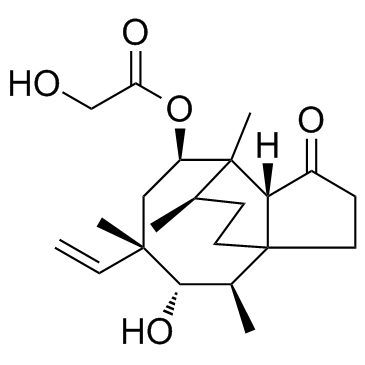
截短侧耳素制备
可用于大量生产高纯度产物的制备式(I)14-O-[(N-(3-甲基-2-氨基-丁酰基-哌啶基)硫烷基乙酰基]木替灵(mutilin)的方法,其中与硫原子连接的哌啶环碳原子是(S)-构型或(R)-构型,以及14-O-[(N-3-甲基-2-(R)-氨基-丁酰基-哌啶-3(S)-基)硫烷基乙酰基]木替灵盐酸盐新结晶形式。
权利要求
1.用于制备下式哌啶基硫烷基乙酰基木替灵的方法, 式I中,与硫原子连接的哌啶环碳原子是(S)-构型或(R)-构型,并且与哌啶环连接的2-氨基-3-甲基-丁酰基基团是(S)-构型或(R)-构型,所述方法包括以下步骤:
a)使下式N-保护的哌啶基硫烷基乙酰基木替灵脱保护, 并且分离游离形式或酸加成盐形式的下式化合物, 式III中,与硫原子连接的哌啶环碳原子是(S)-构型或(R)-构型,
b)用被保护为烯胺且被活化为碳酸混合酸酐的(R)-或(S)-缬氨酸酰化所述式III化合物,以形成下式化合物, 式IV中,R1和R2是C1-4烷基,且R3是氢或C1-4烷基,
c)使式IV化合物脱保护,并分离式I化合物。
2. 权利要求l的方法,其中分离可药用盐形式的式I化合物。
3. 权利要求1或2的方法,其中分离作为盐酸盐的式I化合物。
4. 权利要求l的方法,其中所述式III化合物是与曱磺酸的加成盐。
5. 权利要求l-4的方法,其中所述N-保护基团是叔丁氧基羰基 基团。
6. 权利要求1的方法,其中通过使诸如曱磺酸酯、苯磺酸酯或 曱苯磺酸酯的截短侧耳素-22-0-磺酸酯与N-保护的哌啶硫醇反应制 备所述N-保护的哌啶基硫烷基乙酰基木替灵。
7. 权利要求6的方法,其中通过使截短侧耳素-22-0-磺酸酯和 N-保护的哌啶硫醇反应制备所述N-保护的哌啶基硫烷基乙酰基木替 灵,所述哌啶硫醇中与硫原子连接的哌啶环碳原子是(S)-构型或(R)-构型。
8. 权利要求1-7的方法,其中所述被分离的式I化合物是3-取 代的哌咬基硫烷基乙酰基木替灵。
9. 权利要求l-8的方法,其中所述3-取代的哌咬基-硫烷基乙酰基木替灵是14-0-[(N-3-曱基-2-(R)-氨基-丁酰基-哌啶-3(S)-基)疏烷基乙酰基]木替灵盐酸盐。
10. 在权利要求1中定义的式IV化合物。
11. 权利要求10的化合物,其中R!和R2是曱基,且R3是氢。
12. 结晶形式的权利要求ll的化合物。
13. 结晶形式的式m化合物的酸加成盐。
14,结晶的14-0-[(N-3-曱基-2-(R)-氨基-丁酰基-哌啶-3(S)-基)硫 烷基乙酰基]木替灵盐酸盐。
15. 3-(S)-非对映体过量^97 %的权利要求14的化合物。
16. 权利要求14的化合物,其具有如下XRD峰2-0角度[2-0]6.2 ±0.2 10.9 士0.212.3 ±0.213.4 ±0.2 14.1 ±0.2 20,8 士0.2
17. 用于制备权利要求14的结晶化合物的方法,包括以下步骤:-将14-0-[(N-3-甲基-2-(R)-氨基-丁酰基-哌啶-3(S)-基)硫烷基乙酰基]木替灵盐酸盐在水介质中溶解并加温 -任选将所得溶液接晶种并在高温下搅拌 -冷却所得到的悬浮液并在环境温度下搅拌 -分离结晶产物并任选重复所述过程。
18. 含有结晶14-0-[(N-3-曱基-2-(R)-氨基-丁酰基-哌啶-3(S)-基) 硫烷基乙酰基]木替灵盐酸盐的药物组合物。
说明制备截短侧耳素的方法本发明涉及用于制备14-0-[(N-(3-曱基-2-氨基-丁酰基-哌啶基)硫烷基 乙酰基]木替灵(mutilin)的新方法。
截短侧耳素,即式的化合物,是天然存在的抗生素,例如由担子菌Pleurotus mutilus和 P.passeckerianus产生,例如参见默克索引,第12版,第7694项。已经例如作为抗菌剂开发了许多其它的截短侧耳素,它们具有主要 的截短侧耳素环结构并且在羟基上被取代。由于它们显著的抗菌活性, 已发现诸如在WO 02/22580中公开的一组截短侧耳素衍生物,即缬氨酰 基取代的哌啶基硫烷基乙酰基木替灵特别有用。为生产基本上纯的这组 化合物的异构体,有必要开发便于用于工业规模并且避免应用昂贵的原 料、危害环境的试剂和溶剂、或耗费时间且费力的纯化步骤的方法。一方面,本发明提供了用于制备下式化合物的方法,式I中,与硫原子连接的哌啶环碳原子是(S)-构型或(R)-构型,并且与哌啶环连接的2-氨基-3-曱基-丁酰基基团是(S)-构型或(R)-构型,所述方法包括 以下步骤:a)使下式N-保护的哌啶基硫烷基乙酰基木替灵脱保护,并且分离游离形式或酸加成盐形式的下式化合物,式IV中,Ri和R2是Q-4烷基,且R3是氢或CM烷基,c)使式IV化合物脱保护,并分离式I化合物。在优选的实施方案中,分离可药用盐形式的式I化合物。在更优选的 实施方案中,分离作为盐酸盐的式I化合物。在式I化合物中,哌啶环的碳原子与硫原子连接。该键可以位于该哌吱环的任何位置,例如相对于哌啶环氮原子的ot、 P或y位,优选(3位。通过酸裂解保护基团进行N-保护的式n化合物的脱保护以形成酸加 成盐,对于式II化合物中与硫原子连接的哌啶环碳原子的构型而言,所 述酸加成盐为异构混合物。式II化合物木替灵中的构象优选与天然产生 的木替灵相同。通过以得到基本上纯的异构体的方式进行的结晶方便地 分离异构混合物,所述异构体中与硫原子连接的哌啶环碳原子是(s)-构型或(R)-构型。结晶步骤导致了高纯化效果,并且因此结晶形式的式III化 合物非常适合于作为生产哌啶基硫烷基乙酰基木替灵过程中的中间物, 尤其是在工业规模中更是如此。此外,利用结晶形式的式III化合物的还 具有如下优点,即可以省略诸如色谱层析的其它纯化步骤,因为结晶形 式的式III化合物的纯度对于生产缬氨酰基取代的哌啶基硫烷基乙酰基木 替灵而言完全足够。可以应用矿物酸或有机酸完成式II化合物的脱保护。在优选的实施 方案中,应用曱磺酸以形成作为酸加成盐的各自的曱磺酸盐。可以应用 常规的N-保护基团作为式II化合物中名为"Prot"的保护基团。优选应用一又 丁氧基羰基。已显示通过选择合适的脱保护剂可以选择性地提高(S)-构型或(R)-构 型的溶解度,因此可以使异构的(S)-构型与(R)-构型分离。例如,通过应 用曱磺酸作为脱保护剂,结晶的产物是纯(S)-异构体,而(R)-异构体留在 溶液中(参见实施例1F)。在随后的步骤中,通过用被保护为烯胺的(R)-或(S)-缬氨酸酰化式III 化合物而将缬氨酰基部分卩I入基本上纯的所述化合物的异构体中,以形 成式IV化合物。通过使(R)-或(S)-缬氨酸与式R广CO-CH(R3)-COOR2 (其 中R,、 112和R3的定义如上)的P-酮酸酯反应产生受保护的缬氨酸。优选 应用乙酰乙酸曱酯。优选根据混合的碳酸酐方法活化所述缬氨酸。在原 位生产混合酸酐,例如,通过添加新戊酰氯。在添加步骤a)中产生的式7III化合物后,得到式IV的受保护的化合物。与具有例如叔丁氧基羰基的其它保护基团的化合物相比较,这些化合物具有更好的结晶特性。就生 产和分离而言,具有这些更好的结晶特性的化合物更容易操作,并且为进一步纯化提供了更好的机会,例如,就式I的3-取代的哌。定基硫烷基乙 酰基木替灵而言,式IV的被烯胺保护的化合物通过结晶而分离和纯化, 然而相应的叔丁氧基羰基保护的衍生物必须应用繁重且费力的色谱层析 步骤来纯化。通过酸裂解移除式IV化合物的保护基团。在移除乙酰乙酸酯并萃取 后,可以分离式I化合物为游离形式,或者在添加了提供可药用盐的酸并 冻干各自的水相后,作为可药用盐,分离式I化合物为例如盐酸盐的无定 形形式。在优选的实施方案中,与疏原子连接的哌啶环碳原子位于相对于哌 啶环氮原子的P位,即为式I的3-取代哌啶基-硫烷基乙酰基木替灵。更 优选的是,本发明涉及14-0-[(N-3-曱基-2-(R)-氨基-丁酰基-哌啶-3(S)-基) 硫烷基乙酰基]木替灵盐酸盐。本发明还涉及14-0-[(N-3-曱基-2-(R)-氨基-丁酰基-哌啶-3(S)-基)硫烷 基乙酰基]木替灵盐酸盐的新型结晶形式。在水介质中应用结晶化过程将 通过上述反应顺序得到的14-0-[(N-3-甲基-2-(R)-氨基-丁酰基-哌啶-3(S)-基)硫烷基乙酰基]木替灵盐酸盐的冻干无定形化合物转化为结晶形式。可 通过应用晶种以增强和加速该过程。通过再结晶,可使结晶的4-0-[(N-3-曱基-2-(R)-氨基-丁酰基-哌啶-3(S)-基)硫烷基乙酰基]木替灵盐酸盐成为具 有所需一致性和化学及光学纯度的形式。因此得到了对于3-(S)位而言的 非对映体过量2 97%的基本上纯的异构体。通过在6.2 ±0,2、 10.9 ±0.2、 12.3 ±0.2、 13.4 ±0.2、 14.1 ±0.2、 20.8 ±0.2度具有峰2-0的X-光粉末衍射图谱(2-e, CuK-a)表征结晶14-0-[(N-3-曱基-2-(R)-氨基-丁酰基-哌啶-3(S)-基)硫烷基乙酰基]木替灵盐酸盐。其还 可通过在约2927、 1721、 1645、 1462、 1403、 1142 cm"具有特征条带的 红外光谱表征。<image>image see original document page 9</image>图1: 4-0-[(N-3-曱基-2-(R)-氨基-丁酰基-哌啶-3(S)-基)硫烷基乙酰基]木替 灵盐酸盐的粉末衍射图在结晶形式中,14-0-[(N-3-曱基-2-(R)-氨基-丁酰基-哌啶-3(S)-基)硫 烷基乙酰基]木替灵盐酸盐提供了比无定形冻干形式更高的纯度和更好的 稳定性,这在制备含有结晶14-0-[^-3-曱基-2-(11)-氨基-丁酰基-哌啶-3(S)-基)硫烷基乙酰基]木替灵盐酸盐作为活性组分的药物组合物中是有利 的。可通过使14-0-巯基乙酰基-木替灵与在哌啶环氮原子的a、 p或y位 具有离去基团的N-保护的羟基哌啶(例如N-BOC-3(R)-曱磺酰基氧基-哌啶) 反应而制备式II的N-保护的哌啶基硫烷基乙酰基木替灵,如在WO 02/22580公开的那样。更简便而言,并且作为本发明的另一方面,可通过使截短侧耳素-22-O-磺酸酯(例如,曱磺酸酯、苯磺酸酯或曱苯磺酸酯)与N-保护的哌啶硫 醇反应制备N-保护的哌啶基硫烷基乙酰基木替灵。保护基团包括合适的 保护基团,例如常规保护基团。优选应用叔丁氧基羰基作为N-保护基团,并且在另一优选的实施方案中,应用在哌啶环3-位上具有硫醇基团 的N-保护的哌啶。可以应用在带有硫醇基团的碳原子上具有(R)-或(S)-构 象的外消旋或对映体纯的N-保护的哌"定^Tu醇。优选应用作为消旋体的N-保护的哌啶硫醇,以避免使用昂贵的手性 原料。可以从合适的羟基哌啶开始,通过添加N-保护基团(例如,叔丁氧 基羰基)并与磺酰氯或磺酸酐(例如,曱磺酰氯)反应,从而制备N-保护的 哌啶硫醇。通过与具有亲核基团的硫,例如硫代乙酸酯反应,并碱裂解 相应的硫酯(例如,N-BOC-3-(R,S)-乙酰基硫代-哌啶),从而引入硫醇基 团。如果以单个对映异构体的形式应用羟基哌啶(例如,3-(R)-羟基哌 啶),包括应用硫代乙酸酯的亲核取代的上述反应顺序以受控制的方式(瓦 尔登反转)发生,以产生相应的N-保护的哌啶硫醇,所述硫醇中与硫原子 连接的哌啶环碳原子是(S)-构型或(R)-构型(例如,3-(S)-哌啶硫醇)。与截短侧耳素-22-0-磺酸酯的进一步反应提供了式II的N-保护的哌 啶基硫烷基乙酰基木替灵,其中与硫原子连接的哌啶环碳原子是(S)-构型 或(R)-构型。在阐明本发明的以下实施例中,温度是摄氏度。应用了下列缩写:N-BOC-N-丁氧基羰基RT=室温MTBE=曱基叔丁醚在下式中给出了实施例中提及的木替灵环编号:<formula>formula see original document page 10</formula>实施例 实施例114-0-[(N-3-曱基-2-(R)-氨基-丁酰基-哌啶-3(S)-基)硫烷基乙酰基】
木替灵盐 酸盐A. N-BOC-3-(R,S)-羟基-哌啶在10 L反应器中将202.4 g 3-(R,S)-羟基哌啶溶解于4.5 L去离子水 中。加入溶解于1.1 L水中的336 g碳酸氢钠。在室温下将534 g二碳酸二 叔丁酯加入到该剧烈搅拌的溶液中。搅拌过夜后,用CH2C12 (3x)萃取该 混合物。用去离子水洗涤合并的萃取物,并蒸馏除去溶剂。将残留物再 次溶解于CH2C12中,并且将该溶液蒸发至干燥。得到423 gN-BOC-3-(R,S)-羟基-哌啶,无需进一步纯化即可将其用于接下来的步骤。B. N-BOC-3-(R,S)-甲磺酰基氧基-哌啶于0-5。C向5 L CH2C12中的216 g N-BOC-3-(R,S)-羟基-哌啶的溶液中 加入222 mL三乙胺。经45分钟逐滴加入在300 mL CH2C12中的137 g曱 磺酰氯,将温度维持在0-5。C。额外搅拌70分钟后,加入2L去离子水, 并通过添加约90mL2nHCl将pH调节至5.9。分离水相,并用水洗涤有 机相。将溶液蒸发至干燥,得到270-280 g油状残留物。用1 L正庚烷处 理后,发生结晶化。将结晶分离并在真空中干燥。得到250 gN-BOC-3-(R,S)-曱磺酰基氧基-哌啶。 Mp.: 69 。C。1H NMR(CDCI3): 4.71 (m,1H,CHOS02CH3), 3.2-3.6 (m,4H,CHN), 3.05 (s,3H,CH3S02), 1.94 (m,2H,H4), 1.83, 1.54 (2xm,2H,H5), 1.46 (m,9H,叔丁基)。C. N-BOC-3-(R,S)-乙酰差J克代-哌啶在惰性气氛下将2.7 L 二曱基曱酰胺置于反应器中。加温下加入 251.4 g N-BOC-3-(R,S)-曱磺酰基氧基-哌啶。在50。C的内部温度下,立刻 加入256.8 g硫代乙酸钾。在95X:下搅拌90分钟后,将反应混合物转移 至装有4 L水的反应器中。加入4.2 L石油醚。剧烈搅拌5分钟后,移除水相。再次加入水后,用氢氧化钠将pH调节至〉8。将有机相分离,用水 洗涤并用活性炭处理。将溶液蒸发至干燥。在用石油醚、曱苯和乙酸乙 酯在硅土上进行快速色谱法并浓缩含有溶液的产物后,在冷却下发生结 晶化,并得到110gN-BOC-3-(R,S)-乙酰基硫代-哌啶。 Mp.:46-48。C (正庚烷)。1H NMR(CDCI3): 3.79 (dd, 1H, H2), 3.5-3.6 (m, 2H, H3, H6), 3.17-3.27 (m, 2H, H2, H6), 2.32 (s, 3H, CH3S02), 1.99 (m, 1H, H4), 1.55-1.72 (m, H4, H5), 1.47 (s, 9H,叔丁基)。D. N-BOC-哌咬-3-(R,S)-硫醇在惰性气氛中将200 g N-BOC-3-(R,S)-乙酰基硫代-哌啶置于含有3.4 L甲醇的IOL反应器中。经15分钟向这一溶液中加入42g曱醇钠的曱醇 溶液。额外搅拌后,加入170mL5nHCl,使pH值为2.6-3。在蒸发器中 浓缩该溶液。用1.7 L曱基叔丁醚(MTBE)和1.7 L水吸纳所得到的双相混 合物。振荡、分离水相并洗涤后,将MTBE相分离并蒸发,得到170 g 油。1H NMR(DMSO-d6): 3.92 (b, 1H, H6), 3.69 (d, 1H, H2), 2.7-2.9 (m, 3H, H2, H3, H6), 2.61 (d, 1H, SH), 2.00 (m, 1H, H4), 1.64 (m, 1H, H5), 1.45-1,31 (m, 2H, H4, H5), 1.39 (s, 9H,叔丁基)。E. 14-0-[(N-BOC-哌啶-3-(R,S)-基)-硫烷基乙酰基】
-木替灵将359.7 g 22-0-截短侧耳素曱^璜酸酯悬浮于3.2 L MTBE中。加入1350 mL 1 n氢氧化钠和21.1 g氯化千基三丁基铵。将该混合物冷却至15。C ,并逐滴加入在800 mL MTBE中的161.6 g N-BOC-哌啶-3(R,S)-硫醇溶液。在20。C搅拌该双相反应混合物1小时。反应完成后,分离各相。干燥并蒸发有机相,以产生521.5 g油状14-0-[(N-BOC-哌啶-3(R,S)-基)-硫烷基乙酰基]-木替灵,无需经过进一步纯化即将其用于下 一 步骤。1H NMR(CDCI3):6.48 (dd, 1H, H19, J-17.4Hz, J-11.2Hz〉,5.77 (d, 1H, H14, J=8.4Hz),5.34, 5.20 (2xdd, 2H, H20, J=",2Hz, J=1.3Hz; J=17.4Hz, J=1.3Hz),4.0, 3.75, 2.96, 2,01 (b, 6H,做),3.37 (dd, 1H, H", J=10.5Hz, J=6.6Hz),3.19 (m, 2H, SCH2), 2.85 (m, 1H, CHS), 2.36 (dq, 1H- H10, J=6.6Hz, J=6.5Hz),2.11 (b, 1H, H4)1.47 (s, 12H, (CH3)3, (GH3"5》,1.18 (s, 3H, (CH3)18),0.89 (d, 3H, (CH3)17, J=6.9Hz), 0.75 (d, 3H, (CH3〉16, J=6.5Hz).F. 14-0-[(哌啶-3-(S)-硫代乙酰基)]-木替灵曱磺酸盐将521 g 14-0-[(N-BOC-哌啶-3(R,S)-基)-硫烷基乙酰基]-木替灵溶解于 4 L 2-丙醇中并加热至55°C。加入165 mL曱磺酸后,在这一温度下将该 溶液搅拌5 h 。完成BOC-基团的裂解后,将该反应混合物冷却至0°C, 并再搅拌2h。将结晶的产物过滤,用2-丙醇洗涤并在真空中干燥。得到 159.8 g 14-0-[(哌。定-3-(S)-硫代乙酰基)]-木替灵甲磺酸盐。 Mp.:250画255。C。1H NMR(DMSO-d6): 8.58 (m, 2H, NH2+), 6.15 (dd, 1H, H19, J=17.2Hz, J-11.5Hz), 5.57 (d, 1H, H14, J-8.2Hz), 5.07 (m, 2H, H20), 4.5 (b, 1H, OH), 3.41 (s, 2H, SCH2), 2.4 (b, 1H, H4), 2.32 (s, 3H, CH3S03-), 1.37 (s, 3H, (CH3)15〉, 1.07 (s, 3H, (CH3)18), 0.83 (d, 3H, (CH3)17, J=7.0Hz), 0.64 (d, 3H, (CH3)16, J-6.6Hz).G. N-(3-甲氧基-l-曱基-3-氧代-l-丙烯基)-R-缬氨酸,钾盐(R-翔氨酸 Dane盐)在轻微加温下将36.6 g固体KOH溶解于1250 mL 2-丙醇中。加入65 g R-缬氨酸和65.9 mL乙酰乙酸曱酯。将该混合物搅拌并回流2 h。用克 莱森冷凝器和短柱替代回流冷凝器,并通过蒸馏除去约1 L 2-丙醇移除在 缩合反应期间形成的水。然后加入500 mL2-丙醇,并再次蒸馏除去500 mL2-丙醇。将该温溶液倒入3 L MTBE中,并在冰冷却下搅拌约3 h。将 得到的悬浮液在4。C放置过夜(排除湿气)、过滤、用500 mLMTBE洗涤 并干燥,得到N-(3-曱氧基-l-曱基-3-氧代-l-丙烯基)-R-缬氨酸钾盐。H. 14-0-[(N-(3-甲基-2-(11)-]^(3-曱氧基-l-曱基-3-氧代-1-丙烯基-氨基)-丁 酰基)-哌啶-3-(S)-基)-硫烷基乙酰基】
-木替灵(Dane化合物)向2175 mL MTBE中的88.2 g R-缬氨酸Dane盐悬浮液中加入14.5 mL水,并在室温下搅拌该混合物10分钟。将该混合物冷却至0。C并加入 3.5 mL4-甲基吗啉和41 mL特戊酰氯并搅拌1 h。加入2175 mL经预冷的 水(0-4。C)和166.4 g 14-0-[(哌啶-3(S)-硫代乙酰基)]-木替灵曱磺酸盐。通过 添加约210 mL 2 n NaOH使该混合物的pH值保持在7.0。搅拌该冷却的混合物(0。C) 30分钟,由此发生Dane化合物的结晶化。为完成反应,将 该悬浮液加温至30。C并搅拌1 h。随后,通过添加约85 mL 2 n NaOH将 pH值设定为9.5。冷却至0"C并再搅拌2h后,将结晶过滤、用冷水和 MTBE洗涤并在真空中干燥。得到195.4 g作为MTBE-溶剂合物的Dane化合物。Mp.: 136-142 。C。1H NMR (DMSO-d6,两种稳定旋转异构体的1:1混合物):8.87, 8.83 (2xd, 1H, NH, J=9.3Hz)、 6.15 (m, 1H, H19), 5.60, 5.56 (2xd, 1H, H14, J=8.3Hz),5.04 (m, 2H, H20), 4.50 (m, 1H, a -H-Val), 4.37 (s, 1H, CH-烯胺),3.50 (s, 3H, OCH3), 2.42, 2.40 (2xb, 1H, H4), 1.87, 1.85 (2xs, 3H, CHs-烯胺),1.36 (2xs, 3H, (CH3)15),1.07 (s, 3H, (CH3)18), 0.96-0.77 (m, 9H, (CH3)17, (CH3)2Val), 0.64 (m, 3H, (CH3)16).I. 14-0-[(N-3-曱基-2-(R)-氨基-丁酰基-哌啶-3(S)-基)硫烷基乙酰基】
木替将145 g Dane化合物悬浮于1.8 L MTBE和1.8 L水的混合物中。将 该混合物加温至约50。C并剧烈搅拌。通过逐滴添加2 n HC1使pH值保持 在1.0。烯胺保护基团的裂解完成后,进行HPLC。分离有机相,并用 MTBE (每次1,6 L)萃取水相两次以移除乙酰乙酸曱酯。向经搅拌的水相 中加入1.6 L MTBE,并通过添加10 n NaOH将pH调节至10。分离各 相,并用1.6 L份的水萃取MTBE相两次。添加1.5L的水后,通过添加 约100 mL 2 n HC1将pH调节至3.2。在旋转蒸发器中浓缩水相。冻干剩 余的溶液得到117.4g标题化合物。1H NMR (DMSO-d6,两种稳定旋转异构体的~1:1混合物):7.95 (b, 3H, NH3+), 6.15 (dd, 1H, H19, J=17.6Hz, J=11.2Hz), 5.6 (d, 1H, W4, J-8.2Hz〉,5.05 (m, 2H, H20), 4.53 (m, 1H, OH), 4.24, 4.30 (2xd, 1H, a -H-Val, J=4.8Hz),4.08 (dd, 0.5H, H2-哌啶,J=13.7Hz, J=3.3Hz), 3.08 (dd, 0.5Hz, H2-哌啶, J-13.7Hz, J-9.8Hz〉, 3.89 (dd, D.5H, H2-哌啶, J=13.1Hz, J=3.2Hz),3,41 (m, 0,5H, H2-键〉,AB-System: Fehlerl Es ist nicht m6gHch, durch die Bearbeitung von Feldfunktionen Objekte z;u erstellen.A=3.44, Fehler! Es ist nicht m3glich, durch die Bearbeitung von Feldfunkflonen Objekte zu erstellen.B=3.33 (2H, SCH2, J=14.9Hz), 3.42 (m, 1H, H11), 2.83, 2.96 (2xm, 1H, CHS), 2.4 (b, 1H, H4), 1.34 (s, 3H, (CH3)15), 1.05 (s, 1H, (CH3)18), 0.9, 1.0 (2xm, 6H, (CH3)2Val), 0.81 (d, 3H, (CH3)17, J=6.9Hz), 0.63 (m, 3H, (CH3)16).实施例214-0-[(N-3-曱基-2-(R)-氨基-丁酰基-哌咬-3-(S)-基)硫烷基乙酰基]木替灵盐 酸盐的结晶形式将3.0 L水置于反应器中并加温至40 。C。加入1 kg冻干的14-0-[(N-3-甲基-2-(R)-氨基-丁酰基-哌啶-3-(S)-基)硫烷基乙酰基]木替灵盐酸盐,并 用l.OL水冲洗添加装置。约IO分钟后,得到浅黄色溶液。将该溶液接 晶种并在40。C缓慢地搅拌6小时。然后停止加热并在环境温度下将结晶 悬浮液再搅拌64小时。将产物过滤,用1.5L冷水洗涤,并不经干燥而 重结晶,或在真空中于40。C干燥湿产物,得到819g结晶的标题化合 物。重结晶将1.5 L水置于反应器中并加温至50。C。加入第一次结晶中的湿产物 并用1.0 L水冲洗添加装置。将悬浮液加热至70-75°C,直至该产物溶 解。冷却该溶液,接晶种并在40。C缓慢地搅拌6小时。然后停止加热并 在环境温度下将结晶悬浮液再搅拌24小时。将产物过滤,用1.3 L冷水 洗涤,并在真空中于4(TC干燥,得到765 g结晶的标题化合物。 Mp.: 150-155°C。